作者:刘h 时间:2025-08-04
Double Helix Optics的3D单分子高分辨率荧光显微镜成像技术在研究纳米级的细胞结构和组织方面具有重要作用。将不同的宽视野照明方案与目标特异性SBR优化结合在一起的3D显微镜光学平台将有助于对广泛的细胞结构进行更精确的3D显微镜纳米级研究。在这里,Double Helix Optics的研究团队演示了一个多功能的多模式照明光学平台,该平台将光板照明的截面和背景减少功能与均匀平面照明集成在一起。通过对一种位于局灶性粘附复合物中的蛋白质和人骨肉瘤细胞中的肌动蛋白的两种彩色成像验证3D成像超分辨单分子定位3D显微镜成像的显微镜平台。
光学平台示意图
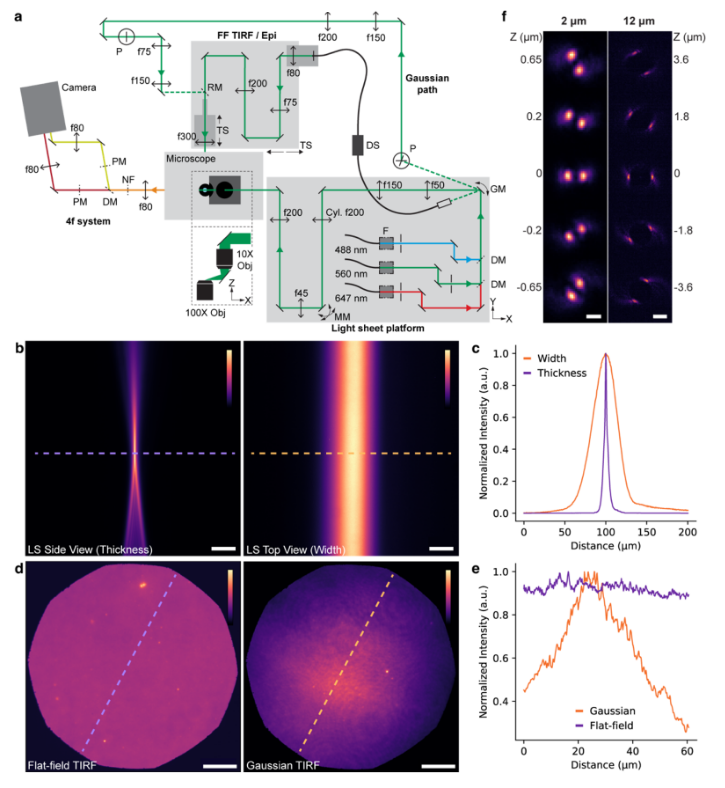
图1:多模态照明平台的设计与性能展示(a)显微镜平台简化示意图(非等比例绘制)
图1(a):集成了五种不同的照明模式的光学平台——光片荧光显微镜、FF和高斯TIRF/落射照明——使用户能够根据他们感兴趣的目标方便地选择合适的方法。使用振镜将光束引导到LS、FF或Gaussian路径,可以在这些模式之间快速轻松地切换。
图1(b):固定Z轴位置下,荧光溶液中采集的光片(LS)荧光显微镜双取向图像:左图侧视图显示LS厚度,右图俯视图显示LS宽度。标尺均为10微米。
图1(c):基于(b)图中虚线位置提取的线性扫描曲线,用于测定LS厚度与宽度。
图1(d):密集荧光微球层3D成像:左图为荧光均匀场(FF)TIRF照明强度分布,右图为高斯分布照明。标尺均为10微米。(e)沿(d)图虚线位置的线性扫描曲线,量化FF照明均匀性(对比高斯分布)。
图1(f):不同轴向位置的荧光微球3D成像:左图展示2微米轴向范围的双螺旋点扩散函数(PSF),右图为12微米轴向范围。左右图标尺分别为1微米和3微米。色阶柱指示线性色谱范围,各图像对比度独立归一化处理。
光片和平场TIRF照明提高了细胞成像的对比度
Double Helix Optics的研究团队通过比较细胞成像的不同照明模式,在对比度改善方面对光学平台的设置性能进行了基准测试。常规高斯和FF照明用于表观和TIRF配置,用于对U-2 OS细胞中用CF568免疫标记的帕西林进行成像[图2(a)]。Paxillin是一种粘附斑蛋白,集中在基材附近,因此是TIRF照明的合适靶标。使用与AF647偶联的鬼笔环肽在标记为f-肌动蛋白的U-2OS细胞中,将荧光显微镜照明与表观照明进行比较[图2(b)]。肌动蛋白存在于整个细胞中,可导致高失焦背景荧光。对于高斯和FF落射和TIRF照明之间的比较,代表性线扫描显示出信背景比的明显趋势,其中高斯落射照明的比率较低,FF TIRF的比率较高——与高斯落射照明相比,提高了4倍[图2(c)]。
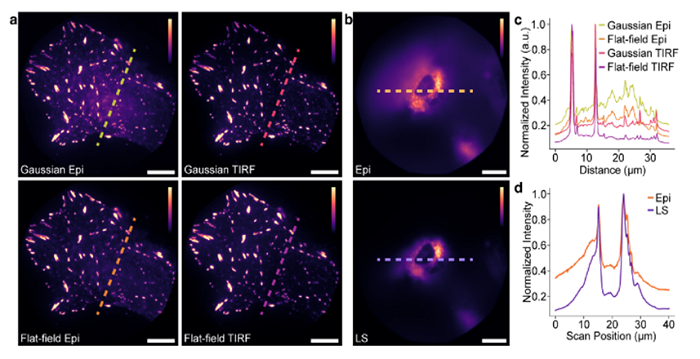
图2.光片(LS)和平场(FF)TIRF照明可提高细胞成像的对比度
图2(a):用CF568免疫标记paxillin的U-2OS细胞的代表性图像,使用高斯落射照明(左上)、高斯TIRF照明(右上)、平场(FF)落射照明(左下)和FFTIRF照明(右下)进行照明。
图2(b):U-2OS细胞的代表性图像,其中肌动蛋白使用与AF647结合的鬼笔环肽进行标记,并使用落射照明(顶部)和光片(LS)照明(底部)进行照明。
图2(c):图表显示(a)中虚线所示的线扫描,表明与其他照明方式相比,使用FFTIRF照明可实现对比度的提高和更均匀的照明。
图2(d):图表显示了(b)中虚线所示的线扫描,表明使用激光扫描照明相比落射照明,对比度显著提升。所有比例尺均为10µm。颜色条表示所使用的线性色标。每幅图像的对比度均已单独归一化。
正如预期的那样,两种TIRF模式产生的对比度比两种落射照明模式更好。当将两种FF模态与两种高斯模态进行比较时,也可以清楚地看到更均匀的照明,其中高斯照明曲线导致位于该样品视场中心的荧光标记的帕西林的强度通常更高,而位于视场外部的帕西林,而FF模式导致整个视野的强度均匀。对于LS与落射照明的比较,在细胞中间对肌动蛋白进行成像时获得的代表性线扫描显示,与落射照明相比,使用LS照明时信背景改善了2倍以上[图2(d)]。
平场TIRF照明的光学平台为单分子定位显微镜提供了更均匀的视场性能
Double Helix Optics的研究团队为了量化与高斯照明相比使用FF的单分子定位性能的改进,将CF568荧光团旋涂到盖玻片上,使用两种照明模式在还原和氧清除缓冲液中用荧光显微镜3D显微镜3D成像,然后使用ThunderSTORM定位。然后根据在FF和高斯TIRF照明下整个视场中的定位不确定性(精度)、定位数量和强度(每个定位的信号光子)对定位分辨率进行量化。对每种模态进行三次重复测量,并将每个数据集分成六个等面积的环,以便比较视野不同部分的统计数据[图3(a),(b)]。
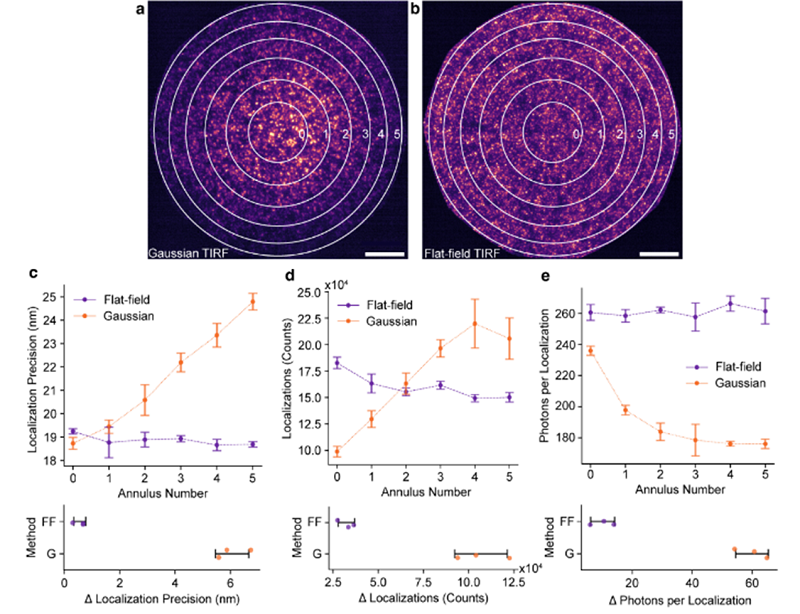
图3.平场TIRF照明为单分子定位显微镜的整个视场提供了更均匀的性能
图3(a、b):用(a)高斯TIRF照明和(b)FFTIRF照明对致密的CF568荧光团层进行成像,显示视场分为六个面积相等的环,以便进行参数量化。比例尺为10µm。(c-e)图表显示了高斯和FFTIRF在环上的比较(上图)以及环5和0之间的平均值(下图)的总体差异A,包括(c)定位不确定性、(d)定位数量和(e)单分子成像中每个定位的光子数(强度)。误差线显示每种照明方式三次3D显微镜3D成像测量的平均值±标准差。
哺乳动物细胞的3D单分子超分辨单分子定位3D显微镜成像
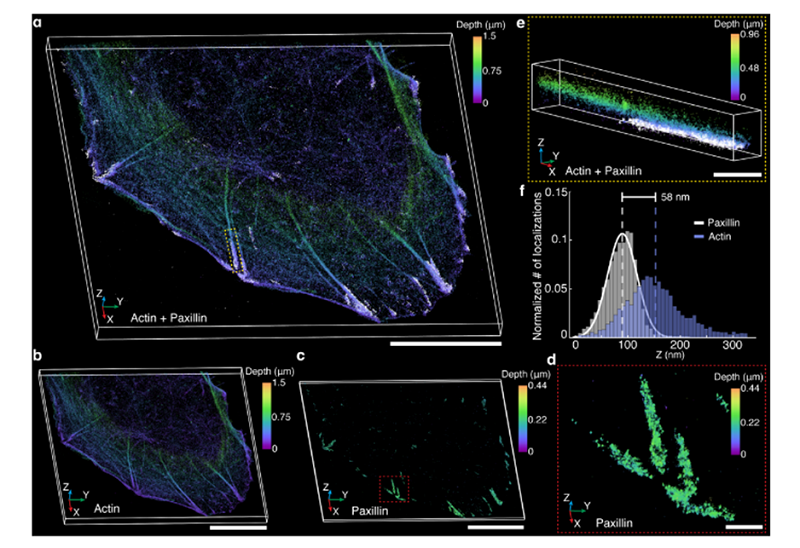
图4.哺乳动物细胞的3D单分子超分辨单分子定位3D显微镜成像,Double Helix Optics显微镜三维相机
图4(a):U-20S细胞中肌动蛋白(基于Z轴位置颜色编码)和桩蛋白(白色)的3D超分辨单分子定位3D显微镜重建。
图4(b):(a)中所示肌动蛋白的3D超分辨单分子定位3D显微镜重建。
图4(c):(a)中所示桩蛋白的3D超分辨单分子定位3D显微镜重建,此处按深度颜色编码。
图4(d):(c)放大(a)中红色虚线框中所示的桩蛋白。
图4(e):放大(a)中黄色虚线框中所示的肌动蛋白和桩蛋白连接。
图4(f):代表性样本的肌动蛋白和桩蛋白定位Z轴位置直方图,用于确定两个目标之间的分离。
在图4中,(a)、(b)和(c)中的比例尺为10微米,(d)和(e)中的比例尺为1微米。
首先,使用LS照明对AF647免疫标记的肌动蛋白进行成像,从而对整个细胞进行光学切片。对间隔1微米的多个重叠切片进行照明,并根据需要进行3D显微镜3D成像以覆盖整个细胞。其中,使用2微米轴向范围的DH-PSF在红色通道中采集单分子数据,并使用12微米轴向范围的DH-PSF在绿色通道中检测所有切片中的盖玻片上的基准珠。在采集过程中,每20帧后,对基准珠进行照明,并使用560nmFFTIRF照明对基准珠进行一帧成像。使用长距离PSF检测基准珠有助于在后处理中进行3D显微镜成像漂移校正和切片拼接。接下来,为了优化盖玻片上的对比度,使用FFTlRF照明对标记有鬼笔环肽的桩蛋白进行绿色通道成像,并使用相同的2微米DH-PSF检测单分子数据和基准珠。每个光片切片和TiRF采集均采集了50,000帧。然后分析这些肌动蛋白和桩蛋白数据集,并将其拼接成单个3D显微镜3D成像重建图像(图4(a)-(d))。这与之前报道的图像非常吻合,证明了该光片荧光显微镜3D单分子高分辨率高精度3D成像显微镜在纳米级3D显微镜3D成像方面的定量性能。
本次实验用到的设备如下表
|
设备名称 |
公司名称 |
型号或参数 |
|
照明激光器 |
Coherent |
488nm,200mW |
|
照明激光器 |
MPB Communications |
560nm与647nm各1000mW |
|
12×18英寸面包板 |
Thorlabs |
MB1218 |
|
倒置显微镜 |
Olympus |
IX-83 |
|
高数值孔径物镜 |
Olympus |
UPLAPO100XOHR,100倍,NA1.5 |
|
XYZ载物台 |
PhysikInstrumente |
OPH-XYS-O&OPH-PINANO-XYZ |
|
光谱滤波 |
Semrock |
FF01-472/27-25 |
|
光谱滤波 |
Semrock |
FF01-554/23-25 |
|
光谱滤波 |
Semrock |
FF01-631/36-25 |
|
线偏振片 |
TowerOptics |
LPVISA050-MP2适配488nm |
|
线偏振片 |
TowerOptics |
LPVISC050-MP2适配560/647nm |
|
四分之一波片 |
TowerOptics |
Z-10-A-.250-B-488 |
|
四分之一波片 |
TowerOptics |
Z-10-A-.250-B-556 |
|
四分之一波片 |
TowerOptics |
Z-10-A-.250-B-647 |
|
三通道驱动器 |
Uniblitz |
VS14S2T1快门配VMM-D3 |
|
二向色镜 |
Thorlabs |
DMLP505T与DMLP567T |
|
振镜 |
Thorlabs |
GVS211,±20°偏转范围 |
|
多功能I/O设备 |
NationalInstruments |
PCIe-6353 |
|
BNC机架连接器 |
NationalInstruments |
BNC-2090A |
|
透镜望远镜 |
Thorlabs |
f=50mm,AC254-050-A |
|
透镜望远镜 |
Thorlabs |
f=150mm,AC254-150-A |
|
柱面透镜 |
Thorlabs |
f=200mm,LJ1653RM-A |
|
一维电动镜 |
Newport |
8807 |
|
透镜 |
Thorlabs |
f=45mm,AC254-045-A |
|
透镜 |
Thorlabs |
f=200mm,ACT508-200-A |
|
照明物镜 |
Mitutoyo |
MY10X-803,10X,NA0.28 |
|
照明物镜支架 |
Thorlabs |
ST1XY-S |
|
XY平台 |
Newport |
401 |
|
Z平移平台 |
Newport |
281 |
|
光纤准直器 |
爱特蒙特光学 |
64786,NA0.55 |
|
方芯多模光纤 |
爱特蒙特光学 |
纤芯尺寸为200×200μm,NA0.2 |
|
去斑器 |
纽波特 |
F-DS-ASQR200-SMA |
|
线性平移台 |
Thorlabs |
TBB1212 |
|
显微镜物镜 |
Olympus |
UPLAPO100XOHR、100X、NA1.5 |
|
多模光纤输出和准直透镜 |
Thorlabs |
f=80mm,AC508-080-A |
|
透镜望远镜 |
Thorlabs |
f=75mm,AC508-075-A |
|
透镜望远镜 |
EdmundOptics |
f=200mm,45417 |
|
科勒透镜 |
EdmundOptics |
f=300mm,45418 |
|
小型线性平移台 |
Thorlabs |
PT1 |
|
透镜望远镜 |
Thorlabs |
f=150mm,LA1417-A |
|
透镜望远镜 |
Thorlabs |
f=25mm,LA1951-A |
|
二向色镜 |
Chroma |
ZT405/488/561/640rpcV33mm厚 |
|
陷波滤光片 |
Chroma |
ZET642NF、ZET561NF |
|
镜头 |
Thorlabs |
f=80mm,AC508-080-AB |
|
二向色镜 |
Chroma |
T660lpxr-UF3 |
|
XYZ平移台 |
Thorlabs |
PT3A |
|
XYZ平移台 |
Newport |
460A-XYZ |
|
4f镜头 |
Thorlabs |
f=80mm,AC508-080-AB |
|
sCMOS相机传感器 |
Hamamatsu |
OrcaFusionBT |
参考文献
1. A. Sharonov and R. M. Hochstrasser, “Wide-field subdiffraction imaging by accumulated binding of diffusing probes,”Proc. Natl. Acad. Sci. 103(50), 18911–18916 (2006).
2. E. Betzig, G. H. Patterson, R. Sougrat, et al., “Imaging Intracellular Fluorescent Proteins at Nanometer Resolution,”Science 313(5793), 1642–1645 (2006).
3. M. J. Rust, M. Bates, and X. Zhuang, “Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy(STORM),” Nat. Methods 3(10), 793–796 (2006).
4. S. T. Hess, T. P. K. Girirajan, and M. D. Mason, “Ultra-High Resolution Imaging by Fluorescence Photoactivation Localization Microscopy,” Biophys. J. 91(11), 4258–4272 (2006).
5. L. E. Weiss, J. F. Love, J. Yoon, et al., “Chapter 4 - Single-molecule imaging in the primary cilium,” in Methods Cell Biol, J. M. Bravo-San Pedro and L. Galluzzi, eds. (Academic Press, 2023), Vol. 176, pp. 59–83.
6. L. Möckl and W. E. Moerner, “Super-resolution microscopy with single molecules in biology and beyond–essentials,current trends, and future challenges,” J. Am. Chem. Soc. 142(42), 17828–17844 (2020).
7. A. M. Sydor, K. J. Czymmek, E. M. Puchner, et al., “Super-Resolution Microscopy: From Single Molecules to Supramolecular Assemblies,” Trends Cell Biol. 25(12), 730–748 (2015).
8. L. von Diezmann, Y. Shechtman, and W. E. Moerner, “Three-Dimensional Localization of Single Molecules for Super-Resolution Imaging and Single-Particle Tracking,” Chem. Rev. 117(11), 7244–7275 (2017).
9. A.-K. Gustavsson, R. P. Ghosh, P. N. Petrov, et al., “Fast and parallel nanoscale three-dimensional tracking of heterogeneous mammalian chromatin dynamics,” MBoC 33(6), ar47 (2022).
10. T. Kanie, J. F. Love, S. D. Fisher, et al., “A hierarchical pathway for assembly of the distal appendages that organize primary cilia,” bioRxiv, bioRxiv:2023.01.06.522944 (2023).
11. H. W. Bennett, A.-K. Gustavsson, C. A. Bayas, et al., “Novel fibrillar structure in the inversin compartment of primary cilia revealed by 3D single-molecule superresolution microscopy,” MBoC 31(7), 619–639 (2020).
12. A. Szymborska, A. de Marco, N. Daigle, et al., “Nuclear Pore Scaffold Structure Analyzed by Super-Resolution Microscopy and Particle Averaging,” Science 341(6146), 655–658 (2013).
13. L. Möckl, K. Pedram, A. R. Roy, et al., “Quantitative super-resolution microscopy of the mammalian glycocalyx,”Dev. Cell 50(1), 57–72.e6 (2019).
14. K. Xu, G. Zhong, and X. Zhuang, “Actin, spectrin, and associated proteins form a periodic cytoskeletal structure in axons,” Science 339(6118), 452–456 (2013).
15. B. Huang, S. A. Jones, B. Brandenburg, et al., “Whole-cell 3D STORM reveals interactions between cellular structures with nanometer-scale resolution,” Nat. Methods 5(12), 1047–1052 (2008).
16. W. E. Moerner and D. P. Fromm, “Methods of single-molecule fluorescence spectroscopy and microscopy,” Rev. Sci. Instrum. 74(8), 3597–3619 (2003).
上一篇:KNS-systems主动隔振台在光路系统搭建中的应用,频率0.5-100Hz,稳定时间<0.1s, Aris TT隔振台
下一篇:Atlantic 系列皮秒激光器对不锈钢进行耐腐蚀激光打标,Ekspla皮秒激光器1064nm,10ps, 1000kHz